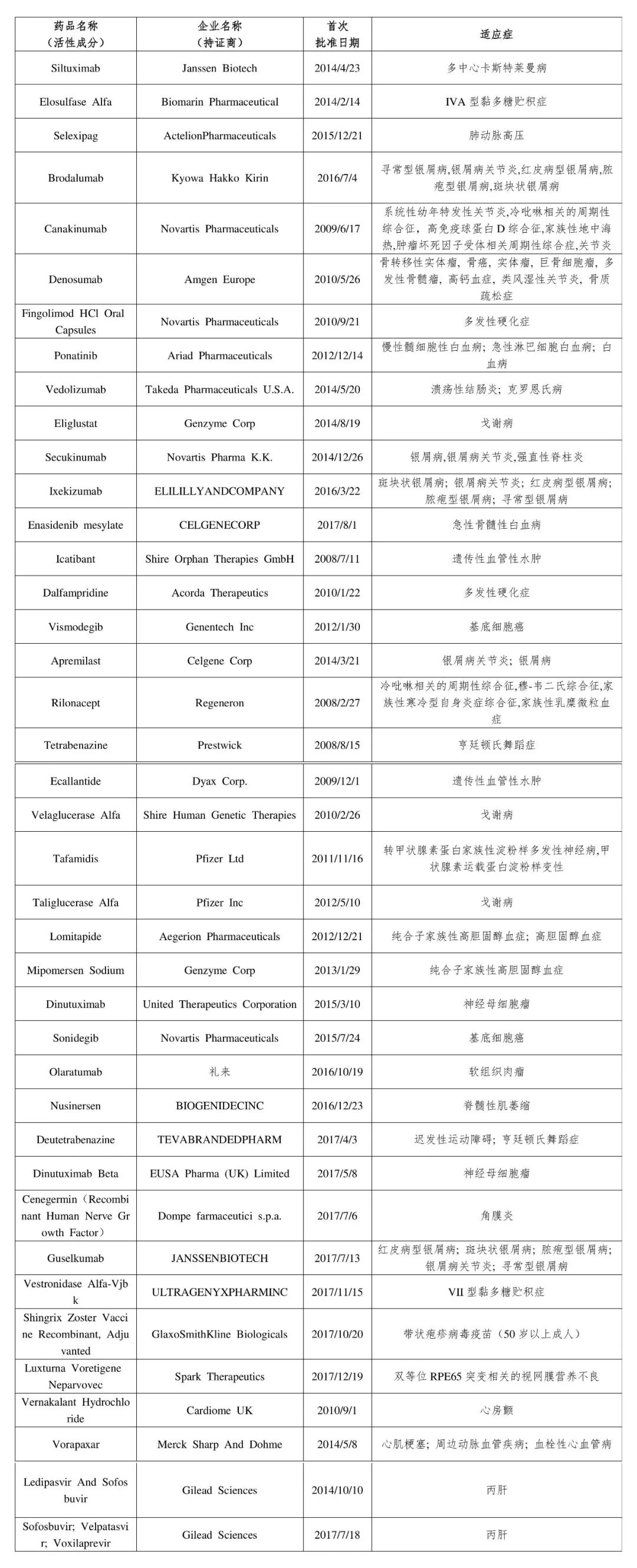
11月1日,国家药监局药审中心(CDE)发布第一批临床急需境外新药名单,共40个临床急需境外新药。
为加快境外已上市临床急需新药进入我国,国家药监局、国家卫健委制定了《临床急需境外新药审评审批工作程序》,并按程序组织专家对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出48个临床急需境外新药。
其中,8个品种已在近期获批上市,分别是肺癌新药安圣莎、PD-1抑制剂可瑞达、PD-1抑制剂利普卓、乳腺癌新药爱博新、降胆固醇新药瑞百安、艾滋病新药捷扶康、罕见病用药舒立瑞和奥巴捷。
列入临床急需境外新药名单的品种,可按照《临床急需境外新药审评审批工作程序》提交相关资料,直接提出上市申请,药审中心建立专门通道加快审评。尚未申报的品种,可随时与药审中心进行沟通交流,尽快提出上市申请。
第一批名单中,罕见病用药得到极大关注,共有23个品种在列,适应症涵盖黏多糖贮积症、多发性硬化症、戈谢病、亨廷顿氏舞蹈症、克罗恩氏病、肺动脉高压等。
其他17款境外新药中,有5款银屑病药物、2款白血病药物、2款丙肝治疗药物。
值得一提的是,这40款药物中,有4款来自诺华,涉及罕见病、银屑病、肿瘤领域;2款来自辉瑞,均为罕见病用药;2款来自吉利德,为丙肝治疗新药。
附:临床急需境外新药名单(第一批)